急性中耳炎の治療には抗菌薬が必須のように感じてしまうかもしれませんが、抗菌薬はなくても自然軽快することがあります。
また、近年、耐性菌の問題もあり、治療の失敗を恐れるせいか、広域抗菌薬(特に第3世代セフェム)が使用されていますが、これも初回治療から広域抗菌薬は必須ではないと考えています。
まずは、急性中耳炎を無治療で経過観察した場合、どのような経過を辿るのかをみてみましょう。
プラセボでも中耳炎は軽快しているという事実
過去に行われたRCTをメタ解析した結果ですが、プラセボ(つまり無治療)でも中耳炎が軽快しているのが分かります。
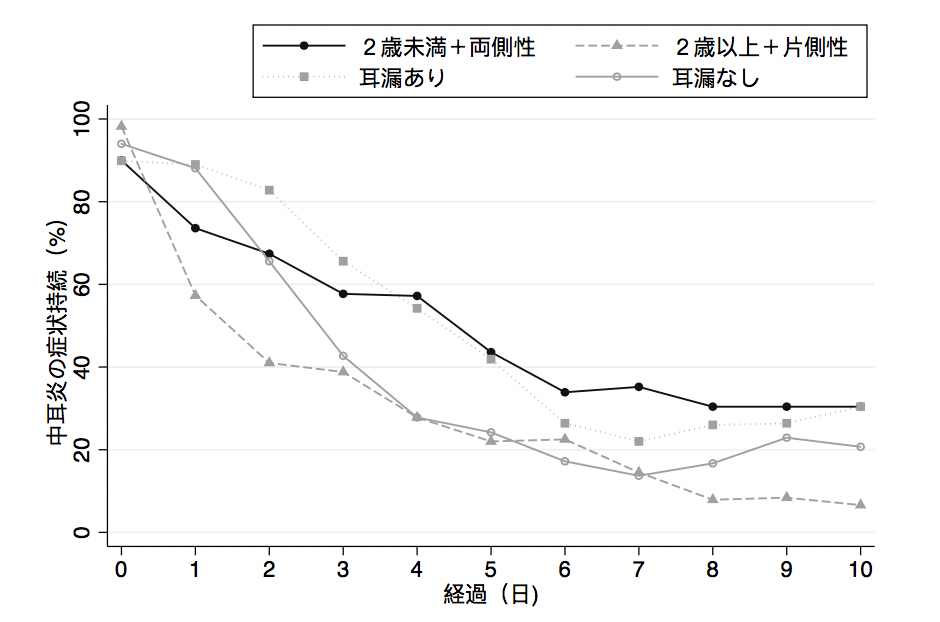
中耳炎に罹患した小児の重症度や年齢にもよりますが、一定数は自然軽快しているのが分かります。
1週間ほどのスパンでみれば、少なくとも6割近くの患者は自然軽快していますし、2歳以上の片側性に限って言えば、1週間後には9割近くが軽快しているのがわかります。
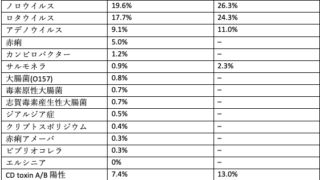
細菌別にみた自然軽快率
急性中耳炎の起因菌はウイルスが20%以下、細菌が70%と推定されており、頻度が多いのは肺炎球菌・インフルエンザ菌・モラキセラの3種類でした5。
細菌感染症となると「すぐに抗菌薬を投与しなければ」と考えてしまいそうですが、実は細菌性でも自然軽快しますし、自然軽快率は起因菌によっても異なります。例えば、起因菌の頻度と自然軽快率は、以下の通りになります:

ペニシリンが第一選択である理由に関して
小児の急性中耳炎ですが、抗菌薬の選択はペニシリンが第一選択です。メタ解析の対象となった6つの研究をみてみましょう。

ほとんどの研究がアモキシシリンを使用して治療に成功しています。残念ながら日本の研究はなく、1990–2000年代の研究が多いですが、広域抗菌薬は必ずしも必要ではないことがわかります。
日本では第3世代セフェムが多用されていますが、おそらくペニシリン耐性肺炎球菌(PRSP)や一部のインフルエンザ菌(BLNAR)、モラキセラあたりの感染症が懸念されてのことと思います。
PRSPに関する考察
肺炎球菌は中耳炎の起因菌として25%〜50%の頻度です5。
意外に思われる方がいるかもしれませんが、ペニシリン高度耐性肺炎球菌(PRSP)は日本の小児では少なく、中等度耐性菌(PISP)であればペニシリンを高用量に使用すれば治療可能です。
例えば、院内感染対策サーベイランス(JANIS)のデータ12によると、非髄膜炎でのPRSPは0.9%、PISPは2.4%、PSSPは96.7%です。初診患者でPRSPを恐れる必要性はそれほど高くないと考えられます。また、マクロライド耐性肺炎球菌は86%というデータもあり、マクロライドは使用しづらい状況です。
インフルエンザ桿菌とモラキセラについて
中耳炎の起因菌の15%〜30%を占めるインフルエンザ菌に関してはどうでしょうか。JANISのデータによると、アンピシリンに感受性がありそうなのは全体の40%程度です。アモキシシリン・クラブラン酸を使用した場合は、感受性の割合は80%弱です。急性中耳炎の起因菌としてインフルエンザ菌は必ずしも頻度は高くなく、4割程度はアモキシシリン感受性、8割程度はアモキシシリン・クラブラン酸に感受性があります。
モラキセラ・カタラリスは起因菌の5%〜20%と必ずしも頻度は高くなく、自然軽快率が80%と非常に高いです。アンピシリンには耐性がありますが、頻度は低く自然軽快の可能性が高いです。
まとめ
今回は過去のメタ解析結果や国内での耐性菌の状況、それぞれの細菌の自然軽快率を参考にしながら
- 中耳炎でも自然軽快することがある
- 最初から必ずしも広域抗菌薬は必要ない
といった点を説明しました。
参考文献
- Uda K, et al. Nationwide survey of indications for oral antimicrobial prescription for pediatric patients from 2013 to 2016 in Japan. J Infect Chemother. June 2019. doi:10.1016/j.jiac.2019.03.004
- Lieberthal AS, et al. The diagnosis and management of acute otitis media. Pediatrics. 2013;131(3):e964-99. doi:10.1542/peds.2012-3488
- Long SS, Proper CG, Fischer M. Principles and Practice of Pediatric Infectious Diseases, 5e.; 2017.
- Rovers MM, Glasziou P, Appelman CL, et al. Antibiotics for acute otitis media: a meta-analysis with individual patient data. Lancet. 2006;368(9545):1429-1435. doi:10.1016/S0140-6736(06)69606-2
- Siegel RM, Bien JP. Acute otitis media in children: a continuing story. Pediatr Rev. 2004;25(6):187-193. doi:10.1542/pir.25-6-187
- Appelman CL, Claessen JQ, Touw-Otten FW, Hordijk GJ, de Melker RA. Co-amoxiclav in recurrent acute otitis media: placebo controlled study. BMJ. 1991;303(6815):1450-1452. doi:10.1136/bmj.303.6815.1450
- Burke P, Bain J, Robinson D, Dunleavey J. Acute red ear in children: controlled trial of non-antibiotic treatment in general practice. BMJ. 1991;303(6802):558-562. doi:10.1136/bmj.303.6802.558
- Damoiseaux RA, van Balen FA, Hoes AW, Verheij TJ, de Melker RA. Primary care based randomised, double blind trial of amoxicillin versus placebo for acute otitis media in children aged under 2 years. BMJ. 2000;320(7231):350-354. doi:10.1136/bmj.320.7231.350
- Little P, Gould C, Williamson I, Moore M, Warner G, Dunleavey J. Pragmatic randomised controlled trial of two prescribing strategies for childhood acute otitis media. BMJ. 2001;322(7282):336-342. doi:10.1136/bmj.322.7282.336
- Le Saux N, Gaboury I, Baird M, et al. A randomized, double-blind, placebo-controlled noninferiority trial of amoxicillin for clinically diagnosed acute otitis media in children 6 months to 5 years of age. Cmaj. 2005;172(3):335-341. doi:10.1503/cmaj.1040771
- McCormick DP, Chonmaitree T, Pittman C, et al. Nonsevere acute otitis media: a clinical trial comparing outcomes of watchful waiting versus immediate antibiotic treatment. Pediatrics. 2005;115(6):1455-1465. doi:10.1542/peds.2004-1665
- 厚生労働省. 院内感染症対策サーベイランス(JANIS). https://janis.mhlw.go.jp/index.asp. Accessed August 8, 2019.