近年、臨床研究は非常に盛んに行われ、薬剤疫学の役割も非常に高まっています。
今回は、臨床研究における薬剤疫学の役割について解説していこうと思います。
医薬品開発の段階
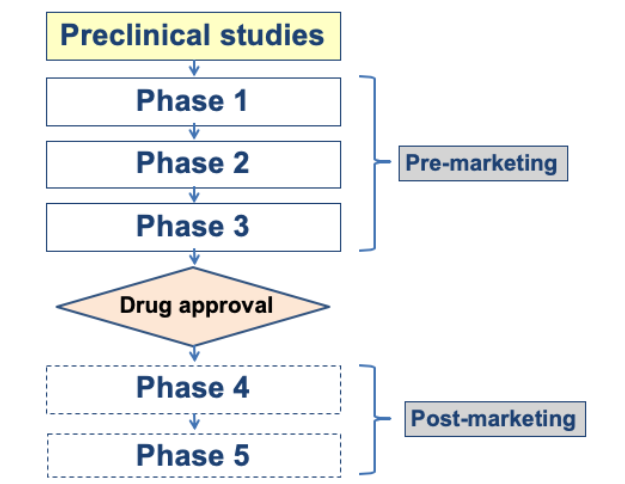
こちらは医薬品開発の段階(Phase)を示した図です。
医薬品の開発には臨床試験が欠かせません。その段階の分類は様々ですが、Phase 1〜5まで分類されており、1〜3は市販前、4〜5は市販後と大まかに分類されることがあります。
それぞれの段階での臨床試験について、簡単に説明していきましょう。
第1相臨床試験:Phase 1 Clinical Study
まずは第1相臨床試験についてです。
第1相臨床試験は、試験参加者は非常に少なく、20〜80名ほどです。一般的には、基礎疾患のない健康な人からボランティアを募って行われます。
目的ですが、
- 安全性と忍容性の評価
- 薬物動態の確認
- 一般的な毒性反応や安全な投与量の範囲を確認
などが該当します。
第2相臨床試験:Phase 2 Clinical Study
試験参加者は比較的少なく(n=50〜300)、ターゲットとする疾患の患者から選ばれます。
研究参加には厳格な基準が用いられることが多いです。
研究の目的は様々ですが、
- 用量の設定:最適な用量を見つける
- 標的疾患患者における薬物動態を確認する
- 疾患患者における一般的な有害事象を把握する
- 有効性の判定(IIb)
などが一般的です。
第3相臨床試験:Phase 3 Clinical Study
第3相臨床試験の参加者は比較的多く、500〜10,000人程度です。参加者はターゲットとする疾患の患者から選ばれます。
目的ですが、大規模な試験を行い、
- 有効性
- 安全性
- リスク・ベネフィット
の評価を提供することです。
第4相臨床試験:Phase 4 Clinical Study
第4相臨床試験の参加者は非常に多く(> 数千)、一般集団で投薬されている人が対象となります。この試験の目的ですが、「Real-world(現実世界)」において、
- 処方薬の有効性
- 安全性および最適な使用に関する追加情報
(例えば、稀な事象、薬物相互作用、特定のサブグループ) - 長期安全性/有効性
を評価することです。
時に公的機関から要求されることもある。多くの場合は、観察研究で実施されます。
第5相臨床試験:Phase 5 Clinical Study
第5相臨床試験の参加者ですが、より一般的な日常診療で薬を内服している個人が対象となります。第5臨床試験の目的ですが、
- 新規適応症の特定
- 「オフラベル」での有効性の確認
- 一部の集団における薬物の有効性
- 一部の集団における安全性 (例:薬物相互作用)
などが該当します。
市販後の薬品を監視する役割や、新規適応のRCTにつながることもあります。
薬剤開発コスト

薬剤開発には非常に多くのコストが生じています1。
有効性の可能性を検証する物質が5,000〜10,000ほどあったとして、このうち動物実験などされるものは250、その後に臨床試験に入るのが10、最終的に認可されるのは2と言われています。
新薬には特許がありますが、特許は20年ほどです。医薬品が開発から販売されるまでに、平均して8〜10年ほどかかるため、特許が保護されて販売できる期間は10〜12年となります。
一方で、医薬品の開発には8〜20億ドル(800億〜2兆円)ほどコストがかかると言われています(承認に至らなかった費用も加味されています)。
医薬品開発における薬剤疫学の役割
医薬品開発における薬剤疫学の役割ですが、疫学は臨床試験と観察研究は医薬品開発に重要な役割を果たしています。
医薬品開発の基本は常に臨床試験で、有効性を決定するためのゴールドスタンダードです。
アメリカなどでは、FDAなど公的機関によって、新規医薬品の承認にはRCTが要求されています。
一方で、観察研究は、医薬品の開発段階や市販後の段階で用いられています。
近年、Phase 4-5で行われる観察研究に対する関心は高まりつつあります。
エビデンスレベルについて
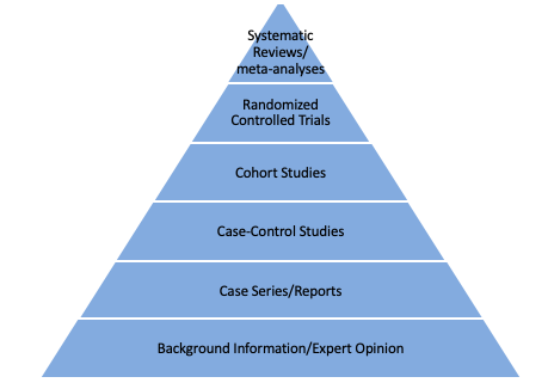
よく見かけるエビデンスピラミッドです。システマティックレビューとメタ解析を頂点に、研究デザインを格付けしています。
研究デザインによるエビデンスの違いを理解するにはちょうどいいのですが、現実はこんなに単純ではありません。
大規模データを利用する際は、主に市販後調査で利用されることが多いでしょう。利用目的は主に2つで、有効性の評価と、公衆衛生学上の意思決定の情報提供です。
市販後調査では、実際の使用率のモニター、市販後の有効性や医薬品の安全性の監視、予後の予測などを行います。
意思決定に関する情報提供ですが、薬が適切に使用されているのか、どのくらいの母集団で使用しているのか、利点と欠点のプロファイルを分析したりします。
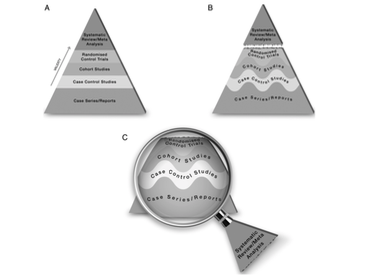
(図2)
実際にはエビデンスレベルはAのように明瞭なものではありません。それぞれの研究にはバイアスが入る可能性もあるためです。
また、システマティックレビュー・メタ解析ですが、「エビデンスの頂点」と考えるより、「過去に行われた研究を検索し吟味するツール」という考え方が私個人としてはしっくりきます。
医薬品開発には疫学が不可欠
医薬品開発には疫学が不可欠です。医薬品開発に疫学的な見地を加えることで、
- 疾患の自然歴に関するデータが分かる
- 現在の治療法および治療パターンに関する情報が分かる
- 併存疾患およびアウトカム発生の理解ができる
- 医薬品の安全性を監視するプログラムを支援できる
- 実世界(Real-world)での使用、有効性の比較、安全性に焦点を当てた研究が行える
などの役割を担うことができます。
薬剤疫学の分野は成熟し続けています。
ISPE(International Society for Pharmacoepidemiology)の教育委員会3は、薬剤疫学の中核を明確にし、次のような能力が不可欠であるとしています:
- 医薬品安全性監視
- 曝露データの分析
- 疫学的方法
- コミュニケーションスキル
市販後調査の必然性
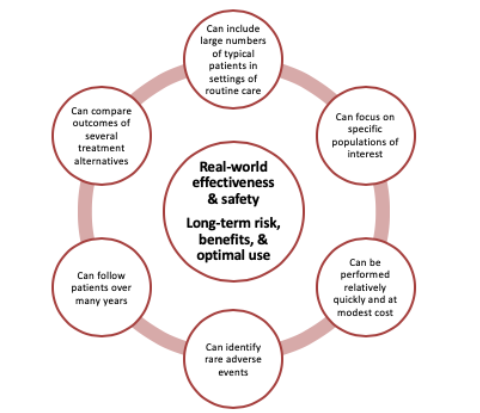
(図4)
「臨床試験こそすべて」「RCTのみの結果を信用する」など極端な意見もあるようですが、市販後に行われる観察研究は重要な証拠を提供しています。
というのも、臨床試験の設定が現実世界を反映していない可能性があるからです。
臨床試験が現実世界を反映していない可能性
「なぜ、現実世界を反映していないのか?」と疑問に思われる方がいるかもしれません。RCTでは、患者の選択は慎重に行われており、その薬剤が使用される一般的な患者を代表しないことがあるからです。
このため、RCTの結果といえども、主要な患者群は過小評価されている可能性があります。
また、RCTでは患者はより綿密の外来でフォローされます。このため、現実世界よりも、より良い医療を受けている可能性があります。
RCTの限界について
中には生涯にわたって内服する薬もあるのですが、RCTは基本的に短期間の治療効果を見ています。
また、適切な比較対照を見つけることは困難な場合がありますし、代替エンドポイントが臨床的に意味のある転帰なのか会議的なケースもあります。
さらに、RCTには多額のコストがかかります。
その他の問題点として、市販前の臨床試験において安全性を十分に評価することは困難です。
これは、研究の参加者数に制限があるためです。
例えば、患者3000人を対象とした試験では、発生率が1000人あたり1未満の有害事象を確実に検出することはできません。患者500人を対象とした試験では、発生率が166人あたり1未満の有害事象を確実に検出することはできないです。
現に、医薬品の約20%が、発売後に「副作用の恐れがある」と警告を受けています。さらに、安全性の理由から、最終的には4%以下の薬物が発売中止となっています。
このように、市販前のRCTだけでは有効性と安全性の評価は不十分なのです。
製薬業界での疫学の役割
製薬業界での疫学の役割は多義に渡ります:
- 医薬品開発
- 前臨床試験から承認まで
- 医薬品開発における安全性
- 有害事象の発生率を理解する
- 医療経済学:新しい医薬品の「価値」や「費用対効果」を理解する
- 承認後の医薬品安全性の監視
などが挙げられます。
記述疫学研究
例えば記述疫学に関する研究をする場合、
- ターゲットとする疾患を定め
- 発生率/有病率や疾患の自然経過を確認し
臨床試験の開発をサポートできます(Hypothesis generating processと言われることもあります)。
さらに、対象集団の特徴や、臨床的に使用できるアウトカムの設定などに貢献できます。
さらに、ターゲットとする疾患または併用療法に関連する副作用や、現在の治療法で未解決の点やニーズを炙り出すことも可能です。
研究デザインへの貢献
疫学は臨床研究のデザインへも交換することができます。例えば、
- 症例の定義や確認方法
- アウトカムの設定や検証
- 包含/除外基準
- 収集する交絡因子のデータ
- 主要エンドポイント
などが該当します。
医薬品開発の後期段階での貢献
薬剤疫学は、医薬品開発の後期段階でも貢献可能です。例えば、
- 臨床試験で生じる安全性シグナルの評価
- 単一群で行われた臨床試験の追試
- 医薬品の承認申請
- 満たされていない医療ニーズの把握
- リスク管理計画
- 患者集団の把握
- リスク・ベネフィットの評価
などが挙げられます。実際に行われる研究としては、
- 医薬品の安全性を監視する研究:Pharmacovigilance study
- 有効性と安全性の比較:Comparative effectiveness research
- 現実の有効性と安全性:Real-world effectiveness and safety
- 長期的な有効性と安全性
- 一部の集団における利益・リスク
- 新規の適応、適応の拡大
などが該当します。
おわりに
今回は、臨床試験、薬剤疫学と新薬開発について少し説明しました。
次回は、FDAのSentinelを例に、薬剤の安全性の評価について解説できればと思います。
参考文献
- Masia N. The cost of developing a new drug. Focus on Intellectual Property Rights. U.S. Dept of State 2008.
- Murad MH, Asi N, Alsawas M, Alahdab F. New evidence pyramid. Evid Based Med. 2016;21(4):125-127. doi:10.1136/ebmed-2016-110401
- Jones JK, Tilson HH, Lewis JD. Pharmacoepidemiology: defining the field and its core content. Pharmacoepidemiol Drug Saf. 2012;21(7):677-689. doi:10.1002/pds.3198
- Avorn J. In defense of pharmacoepidemiology–embracing the yin and yang of drug research. N Engl J Med. 2007;357(22):2219-2221. doi:10.1056/NEJMp0706892